中和滴定の発展問題で、中和点でのpHの解法は少し複雑です。
(1) 酢酸の濃度を c = 0.4 [mol/L]、電離度をαとすると
[電離前] 0.40 0 0 [mol/L]
[平衡時] 0.40(1-α) α α [mol/L]
Ka =
∴
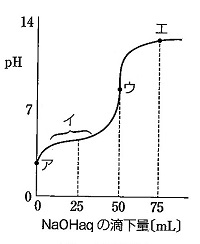
(2) 領域イでは、酢酸と酢酸ナトリウムの緩衝液となっており、緩衝作用を示すから。
(3)-ウ.点ウは中和点、より、
反応前後のモル濃度は
また、水溶液の体積は点アの2倍である。したがって、
は完全に電離し、生じた
は加水分解して、
加水分解定数
分解前ののモル濃度を
、加水分解により生じる[
とすると、
[分解前] c
0 0
[平衝時]
x x
より、
また、より、
∴
(3)-エ.の化学反応において、強塩基
の一部が残り、
その物質量は反応前の酢酸の倍で、水溶液の体積は反応前の
倍であるから、
∴

コメントをお書きください