金属イオンの分離の問題です。難易度は少し難。
慶應大学(薬) 制限時間(10分)
この問題は、金属イオンと試薬の両方を求める複雑な分離で、表を作りながら整理することで要領よく解くことができます。HgO(黄)はほとんどのテキストには記述されていないので、それ以外を決定していく中で推測します。
覚えるときには、まず基本的な試薬の操作手順(たとえばHCl→H2S→NH3→H2S→・・・)を覚えます。次にそれぞれの試薬に反応する金属イオンを色を含めて正確に覚えます。その上で、さまざまな問題を解くと、効率よく暗記できます。
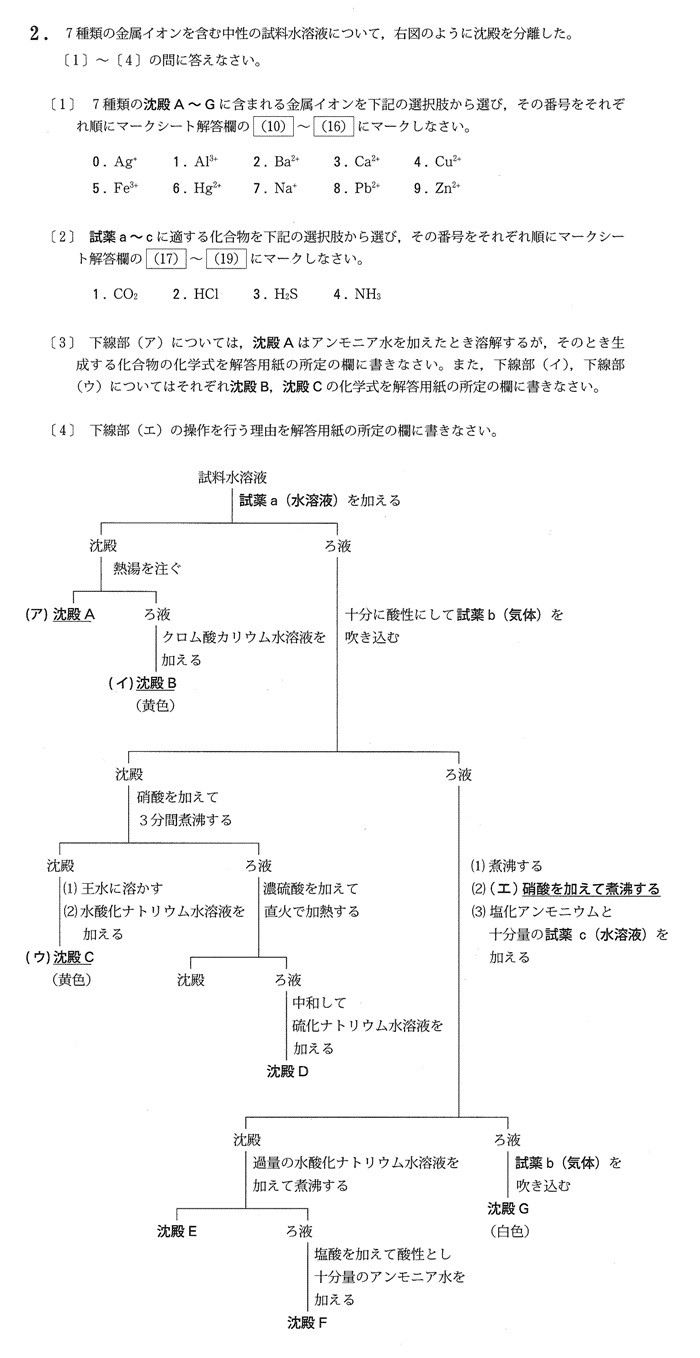
<< 解答 >>
[1] A 0 B 8 C 6 D 4 E 5 F 1 G 9
[2] a 2 b 3 c 4
[3] (ア) [Ag(NH3)2]+ (イ) PbCrO4 (ウ) HgO
[4] 硫化水素で還元され生じたFe2+を酸化してFe3+に戻すため。
<< 解法 >>
金属イオンをイオン化傾向の大きい順に並べるのがコツです。
|
イオン 試薬 |
Ba2+ 無色 |
Ca2+ 無色 |
Na 無色 |
Al3+ 無色 |
Zn2+ 無色 |
Fe3+ 黄褐色 |
Pb2+ 無色 |
Cu2 青色 |
Hg2+ 銀色 |
Ag+ 無色 |
|
|
HCl 水溶液 |
― |
× |
× |
× |
× |
× |
× |
PbCl2 白 |
× |
× |
AgCl 白 |
|
H2SO4 水溶液 |
― |
BaSO4 白 |
CaSO4 白 |
× |
× |
× |
× |
PbSO4 白 |
× |
× |
× |
|
H2S ガス |
酸性
|
× |
× |
× |
× |
× |
Fe3+ →Fe2+ S2ー→S(白) |
PbS 黒 |
CuS 黒 |
HgS 黒 |
Ag2S 黒 |
|
塩基性 |
Al(OH)3 白 |
ZnS 白 |
FeS 黒 |
||||||||
|
NH3 水溶液 |
少量 |
× |
× |
× |
Al(OH)3 白 |
Zn(OH)2 白 |
Fe(OH)3 赤褐 |
Pb(OH)2 白 |
Cu(OH)2 青白 |
× |
Ag2O 褐 |
|
過剰量 |
無色 液3 |
深青 液2 |
無色液1 |
||||||||
|
NaOH 水溶液 |
少量 |
× |
Ca(OH)2 白 |
× |
Al(OH)3 白 |
Zn(OH)2 白 |
Fe(OH)3 赤褐 |
Pb(OH)2 白 |
Cu(OH)2 青白 |
HgO 赤 (黄) |
Ag2O 褐 |
|
過剰量 |
無色 液5 |
無色 液4 |
無色 液6 |
||||||||
|
CO2 ガス |
― |
BaCO3 白 |
CaCO3 白 |
× |
× |
× |
× |
× |
× |
× |
× |
|
CrO42- 水溶液 |
― |
PbCrO4 黄 |
× |
× |
× |
× |
× |
PbCrO4 黄 |
× |
× |
Ag2CrO4 赤褐 |
※1 Al2S3が生成されるが直ぐに加水分解してAl2(OH)3になる。
無色液1 [Zn(NH3)4] 2+ 深青液2 [Cu(NH3)4] 2+ 無色液3 [Ag(NH3)2]+
無色液4 [Zn(OH)4] 2+ 無色液5 [Al(OH)4] + 無色液6 [Pb(OH)4] +
アルカリ金属(Li+, Na+, K+など)は、沈殿をつくらないので炎色反応で検出する。
[試薬a] HClaq と CO2ガスが考えられるが、熱湯で溶けるのはPbCl2のみであるから、HCl(試薬a)
→ AgCl(沈殿A)、PbCrO4(沈殿B)
[試薬b] 酸性溶液で沈殿を生じさせるのはH2S(試薬b)
のみ。
→ 沈殿物はHgS, CuS で、硝酸で溶けるのは CuS、溶けないのはHgS。
→ HgS → 王水で Hg2+ → NaOHaq で HgO(沈殿C)。
→ CuS → 硝酸で Cu2+ → Na2Saq で CuS(沈殿D)
[試薬c] (1) 煮沸で H2S を除去、(2) でFe2+をFe3+にし、
(3) NH4+ を追加することでNH4+ + OH- ⇆ NH3 + H2O の平衝を右に偏らせ NH3 の濃度を大きくする。
→ NH3(試薬c)
→ 沈殿物はFe(OH)3, Al(OH) 3 → 過剰のNaOHaq で溶けないのはFe(OH)3(沈殿E)、
Al2(OH) 3は溶けて[Al(OH)4] + → NH3によってAl(OH)3(沈殿F)
→ ろ液には Ba+, Ca+, Na+, [Zn(NH3)4] 2+、この中で H2S で沈殿するのはZn2+のみ → ZnS(沈殿G)

コメントをお書きください
あ (金曜日, 27 1月 2023 15:53)
aの試薬がhclなのにhg2+が沈殿していないのはなぜですか。