「無機化合物の分類」の問題です。難易度は標準(計算のみは、基本で易)。
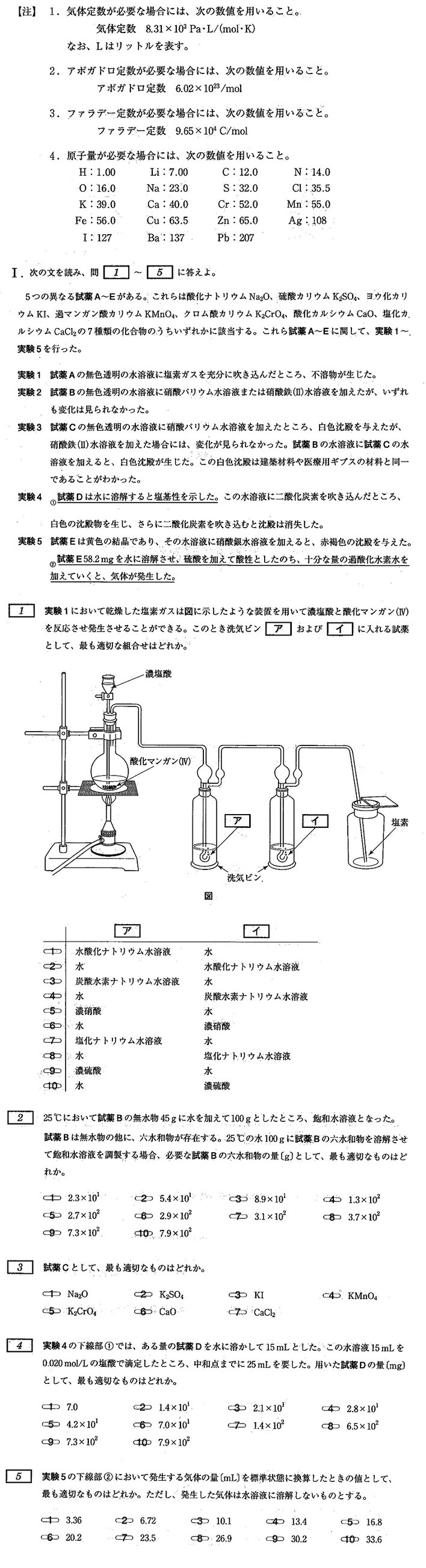
北里大学(薬) 制限時間(10分)
このような問題は表を作成して特定していきます。表作成のテクニックを磨くことで、すべてを覚えていなくても正解できます。
このテクニックは、化学の無機や有機の分類や分離の問題に有効です。
中学受験では化学物質分類や蒸散などの問題で必須で、特に難関中の問題は複雑なので、このテクニックを使い熟せないとほとんど解けません。
公立高校入試では、蒸散の問題で使うと便利ですが分類が簡単で使わなくても溶ける場合が多いので、教え(られ)ない塾が散見されます。
「化学物質の性質」の問題で、試薬を正確に特定した上で、理論化学の定理や公式を使って解きます。また、ここでは実験の問題もあり、観察力も試されています。さらに、難関大の場合、例外なく計算も少し複雑なので速く正確に解く計算力が必須です。
70分36問の問題であり、このレベルの問題が最後まで続くので、要領よく解く練習を繰り返すことが必須です。
答
1. ⑩ 2. ⑩ 3. ② 4. ② 5. ③
< 解法のポイント >
1.表を作成して、試薬を特定します。
※ 試薬数が多い場合、表で特定することが一般的な解法です。
|
実験
試薬 |
液色 |
1 |
2 |
3 |
4 |
5 |
No. |
薬 |
||||||
|
Cl2 |
液色 |
Ba(NO3)2 |
Fe(NO3)2 |
Ba(NO3)2 |
Fe(NO3)2 |
(C)K2SO4 |
溶解 |
CO2 |
黄 |
AgNO3 |
||||
|
A |
B |
C |
B |
D |
E |
|||||||||
|
沈 |
無 |
無色&無変化 |
白沈 |
無変化 |
白沈 |
塩基 |
白沈 |
有 |
赤褐沈 |
|||||
|
Na2O |
無 |
× |
〇 |
〇 |
× |
× |
- |
- |
〇 |
× |
- |
- |
|
|
|
K2SO4 |
無 |
× |
〇 |
× |
- |
〇 |
〇 |
- |
- |
- |
- |
- |
2 |
C |
|
KI |
無 |
〇 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
1 |
A |
|
KMnO4 |
赤紫 |
× |
× |
- |
- |
× |
- |
- |
× |
- |
× |
- |
|
|
|
KCrO4 |
黄 |
× |
× |
- |
- |
× |
- |
- |
× |
- |
〇 |
〇 |
5 |
E |
|
CaO |
無 |
× |
〇 |
〇 |
× |
× |
- |
〇 |
〇 |
〇 |
- |
- |
3 |
D |
|
CaCl2 |
無 |
× |
〇 |
〇 |
〇 |
× |
- |
〇 |
× |
〇 |
- |
- |
4 |
B |
Na2O + H2O → 2NaOH (塩基性)
CaO + H2O → Ca(OH)2 (塩基性)
クロム化合物(緑、黄、赤橙色、赤褐色)で有色
イオン Cr3+ 緑 CrO4- 黄色 Cr2O72- 赤橙色
化合物 BaCrO4 黄色 PbCrO4 黄色 Ag2CrO4 赤褐色
計算式は単純ですが、式量や分子量を速く正確に求め、方程式を要領よく解かないと、ミスしたり制限時間を大幅に超えてしまうので、この手の問題を多数解いて解法のセンスを磨くことが肝要です。
3. CaCl2(式量 111)、6 H2O (分子量 108)である。CaCl2・6 H2O の質量を x g とすると、
100 + 108/219×x : 111/219×x = 55 : 45 この方程式を解く。
4. CaO(式量 56)、CaO + H2O → Ca(OH)2 Ca(OH)2 + 2HCl → CaCl2 + 2H2O である。
CaO の質量を x mg とすると、
(x×1/1000) /56: 0.020×25/1000 = 1 : 2 この方程式を解く。
※ CaO 15 mLは使用しない。この点も看破する。
5. KCrO4(式量 194)、Cr6+ + 3e- → Cr3+、H2O2 → O2 + H2O + 2e- である。
O2 の物質量を x mol とし、求める体積を y mLとすると、
58.2×10-3/194 : x = 2 : 3
y =
x×22.4×1000
これらの方程式を解く。

コメントをお書きください