周期表と無機の基本性質をまとめます。受験で必須の無機は幅広くより多くの性質を覚えないと入試ではほとんど得点できませんが、ここではその骨格となる最も基本的な性質のみを示します。
センター試験では原子番号1~20の暗記が必須です。また、難関大を目指す場合には第4周期まですべて暗記し、周期表に関連する性質を細部まで覚える必要があります。
周期表(第1周期~第4周期の元素)
原子番号1~20(水兵リーベ僕の船、七曲がりシップス クラークか)
He He
Li Be B C N O F Ne
Na Mg Al Si P S Cl Ar
K Ca
第4周期(閣下スコッチバクローマン、鉄子にどうせ会えんが、ゲルマン斡旋ブローカー)
K Ca Sc Ti Ba Cr Mn Fe Co Ni Cu Zn Ga Ge As Br Kr
原子番号92までは自然界に存在するが、それ以降は人工的に作り出されたもの。
原子番号113は日本が命名したアジア初の原子。それ以外はすべて欧米が命名。
このプロジェクトに九州大学も関わったが、関連問題が去年(2017年度)の九州大学の入試(化学)で出題された。
典型元素と遷移元素の主な特徴
|
分類 |
典型元素 |
遷移元素 |
|
族 |
1,2,12~18族 |
3~11族 |
|
元素 |
金属元素と非金属元素 |
すべて金属元素 |
|
最外殻電子の数 |
周期的に変化する。 |
1個または2個(Pbは18個) |
|
性質 |
同族元素(周期表の上下)の性質が似ている。 |
同族元素と同周期元素(上下左右)の性質が似ている。 |
|
酸化数 |
1つだけもつことが多い。 |
複数もつことが多い。 |
|
密度 |
一般的に小さい。 |
一般的に大きい。 |
|
融点 |
一般的に低い。 |
一般的に高い。 |
全元素の約80%は金属である。
遷移元素について、同族元素(11族)のCu, Ag, Au は(金属の中でも)熱・電気伝導性が高く、展性・延性が大きい。
同周期元素(第4周期)のFe, Co, Ni には磁性があり、濃硝酸と不動態をつくる。
典型元素の基本的な性質
(1族の多く)アルカリ金属(リッチ(Li)なかあ(Ca)ちゃんルビ(Rb)ーせし(Cs)めてフラ(Fr)ンスへ)
Li Ca Rb Cs Fr
常温で水と反応し、水素を発生する。
同族(1族)のHは、アルカリ金属ではない。非金属。
(2族の多く)アルカリ土類金属(キャッ(Ca)スル(Sr)にバ(Ba)ラ(Ra))
Ca Sr Ba Ra
常温で水と反応し、水素を発生する。
同族(2族)のBeとMgはアルカリ土類金属ではない。
Mgは、熱水と反応、炎色反応なし、水に溶けにくい。
12族(Zn,Cd,Hgなど)
Znは両性元素
Hgは常温で唯一の液体
13族(B,Alなど)
Alは両性元素
14族[タン(C)スの下(Si)には現金(Ge)すず(Sn)なり(Pb)]
C Si Ge Sn Pb
非金属(C Si)と金属(Ge Sn Pb)のある族。Sn Pbは両性元素
(C ) 炭素、一酸化炭素、二酸化炭素。
(Si) ケイ素、二酸化ケイ素
15族(N,P)
(N ) 窒素、アンモニア、一酸化窒素、二酸化窒素、硝酸、硝酸の製法(オストワルト法)
(P ) リン、十酸化四リン
16族(O,S)
(O ) 酸素、オゾン、酸化物。
(S ) 硫黄、硫化水素、二酸化硫黄、硫酸、硫酸の工業的製法(接触法)
(17族の全て)ハロゲン[ふっ(F)くら(Cl)ブラ(Br)ウス愛(I)のあと(At)]
F Cl Br I At(アスタチン)
1価の陰イオンになりやすい。
酸化力 F > Cl > Br > I(酸化力の強いものはイオンになり弱いものは単体になる)
F2をHCl水溶液に通すと、Cl2が発生し、F2はHFになる。F2+2HCl→2HF+Cl2
ハロゲン化水素(HF, HCl, HBr, HI )。
HFは弱酸性、他はすべて強酸性。HFは二酸化ケイ素(ガラスの主成分)を溶かす。
(18族の全て)希ガス
He Ne Ar Kr Xe Rn
結合をつくりにくく、すべて単原子分子
問題 次の記述のうち、正しいものを選べ。(星薬科大)
1. 元素の周期表の10族から18族を典型元素という。
2. 2族の元素をアルカリ土類金属という。
3. 元素の約20%は金属である。
4. 遷移元素は、異なる族の元素でもよく似た性質を示すことが多い。
5. 1族元素をアルカリ金属という。
答 4
[解説]
1. 典型元素は1,2,12~18族元素をいう。遷移元素は、3~11族元素をいう。
2. Be, Mg はアルカリ土類金属ではない。
3. 元素の80%が金属である。
5. Hはアルカリ金属ではない。
周期表と元素の性質
イオン化傾向(溶液中(主に水溶液中)における元素(主に金属)の陽イオンへのなりやすさ)
[貸(K)そうか(Ca)な(Na)ま(Mg)あ(Al)当(Zn)て(Fe)に(Ni)すん(Sn)な(Pb)ひ(H)ど(Cu)過(Hg)ぎ(Ag)る借(Pt)金Au)]
(Li >Ba >) K Ca Na Mg Al Zn Fe Ni Sn Pb (H) Cu Hg Ag Pt Au
最大は リチウム(Li)。
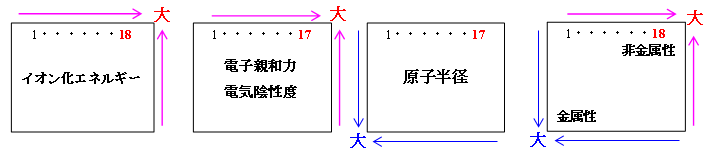
イオン化エネルギー(原子・イオンなどから電子を取り去ってイオン化するために要するエネルギー)
第一イオン化エネルギー(中性原子から電子を取り去ってイオン化するために要するエネルギー)
高校化学では、この第一イオン化エネルギーをイオン化エネルギーを呼んでいる。
周期表の左上ほど大きく右下ほど小さい。
希ガスが最も大きく(中でもHeが最大)。次にハロゲン・窒素・酸素・炭素などが大きい。
アルカリ金属が最も小さい。
小さいほど、陽イオンになりやすい。
電子親和力(最外殻に電子を1つ取り込んで1価の陰イオンになるときに生じるエネルギー)
Cl > F > Br >I > At >・・・
大きいほど陰イオンになりやすい。
ハロゲンが最大で大きく、希ガスが最小で極めて小さい。
電気陰性度(電子を引き付ける力の大きさ)
F > O > Cl ≒ N > Br > I ≒ S ≒ C >・・・
周期表の左上ほど大きく右下ほど小さい。
※希ガスは定義できない。
同素体[ス(S)コッ(C,O)プ(P)]
硫黄(S)単斜硫黄・斜方硫黄・ゴム状硫黄。
炭素(C)黒鉛・ダイヤモンド・フラーレンなど。
酸素(O)酸素・オゾン。
リン(P)赤リン・黄リン。
O,Sは非金属で、C,Pは半導体。
元素の周期的特性
典型元素の酸化物の性質(第3周期)
|
族 |
1 |
2 |
13 |
14 |
15 |
16 |
17 |
|
酸化物 |
Na2O |
NgO |
Al2O3 |
SiO2 |
P4O10 |
SO2 |
Cl2O7 |
|
性質 |
塩基性 |
両性 |
酸性 |
||||
イオン化傾向による金属の反応
|
金属 条件 |
Li |
K |
Ca |
Na |
Mg |
Al |
Zn |
Fe |
Ni |
Sn |
Pb |
(H) |
Cu |
Hg |
Ag |
Pt |
Au |
|
乾燥空気 |
常温で酸化 |
加熱 |
強熱 |
無反応 |
|||||||||||||
|
水 |
常温で反応 |
高温水蒸気 |
ほとんど無反応 |
||||||||||||||
|
酸 |
希酸に溶けて水素発生 |
× |
酸化力強の酸 |
王水 |
|||||||||||||
王水(おうすい、aqua regia)は、濃塩酸と濃硝酸とを3:1の体積比で混合してできる橙赤色の液体。
問題 イオンに関する記述のうち、正しいものを選択しなさい。(明治薬科大)
a 電子親和力の小さい原子ほど陰イオンになりやすい。
b イオン化エネルギーの小さい原子ほど、陽イオンになりやすい。
c イオン結合において働く力は、静電気力(クーロン力)である。
d 塩化ナトリウムの結晶は、NaCl 分子が規則正しく配列したものである。
e イオン結晶は陽イオンと陰イオンからなるため、電気を通す。
答 b,c

コメントをお書きください